重要な副作用とその対策
サイトカイン放出症候群(CRS)※
※:MedDRA/J PTの毛細血管漏出症候群、毛細血管透過性増加、サイトカイン異常、サイトカイン放出症候群(CRS)、サイトカインストーム、サイトカイン検査、及び貪食細胞性組織球症をCRSとした。
- CRSの症状は、多くの患者において軽度から中等度ですが、場合によっては重篤な、生命を脅かす強力なサイトカイン放出(サイトカインストーム)を引き起こすことがあります。
- 本剤投与により、CRSの随伴徴候として、発熱、無力症、頭痛、低血圧、悪心、肝酵素上昇、播種性血管内凝固等があらわれることがあります。また、infusion reaction及びアナフィラキシーショックがあらわれることがあります。
- サイトカイン放出症候群の発現を軽減するためデキサメタゾンの前投与を実施してください。(「投与前及び投与中の注意事項」参照)
1)CRSの発現状況
| 試験名・対象患者 | 全グレード の有害事象 の発現率 |
グレード3以上 の有害事象 の発現率 |
投与中止に 至った有害事象 の発現率 |
初回発現までの 期間中央値 (範囲) |
||
|---|---|---|---|---|---|---|
| 国内第Ⅰb/Ⅱ相臨床試験9) | 成人(n=26) | 12(46.2%) | 1(3.8%) | 1(3.8%) | 1.0(1~128)日 | |
| 小児(n=9) | 5(55.6%) | 0 | 0 | 2.0(1~45)日 | ||
| 海外第Ⅲ相比較 対照臨床試験6) |
本剤投与群 | 成人(n=267) | 43(16.1%) | 13(4.9%) | 3(1.1%) | 2.0(1~254)日 |
| 標準化学 療法群 |
成人(n=109) | 0 | 0 | 0 | - | |
| 海外第Ⅰ/Ⅱ相臨床試験8) | 小児(n=70)a | 10(14.3%) | 5(7.1%) | 2(2.9%) | 2.5(1~51)日 | |
| 海外第Ⅱ相臨床試験7) | 小児(n=45) | 4(8.9%) | 0 | 0 | 6.0(1~52)日 | |
a:1サイクル目の1~7日目は5μg/m2/日、それ以降は15μg/m2/日を投与された患者
本剤投与群で認められた各投与サイクル別のCRSの発現率(海外第Ⅲ相比較対照臨床試験6))
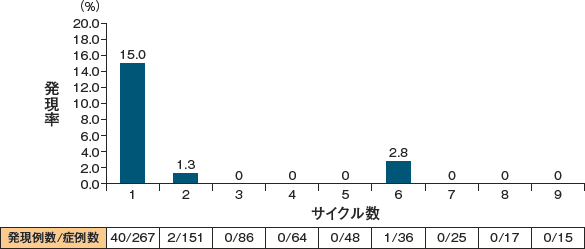
また、国内第Ⅰb/Ⅱ相臨床試験9)、海外第Ⅲ相比較対照臨床試験6)、海外第Ⅱ相臨床試験7)、海外第Ⅰ/Ⅱ相臨床試験8)で発現したCRSは、下記のとおりでした(n=440)。
| 有害事象名 | 全グレードの発現率 | グレード3以上の発現率 |
|---|---|---|
| CRS | 74(16.8%) | 18(4.1%) |
| 毛細血管漏出症候群 | 6(1.4%) | 2(0.5%) |
| 貪食細胞性組織球症 | 6(1.4%) | 5(1.1%) |
| サイトカインストーム | 2(0.5%) | 0(0.0%) |
2)消失までの期間
国内第Ⅰb/Ⅱ相臨床試験9)において、成人ではCRS事象を発現した患者12例全例でCRS事象が消失し、消失までの期間中央値(範囲)は4.0(1~132)日でした。小児では、5例全例でCRS事象が消失し、消失までの期間中央値(範囲)は2.0(1~20)日でした。
また、海外第Ⅲ相比較対照臨床試験6)において、CRS事象を発現した患者のうちCRS事象が消失した患者の割合は95.3%であり、消失までの期間中央値(範囲)は3.0(1~21)日でした。
3)CRSの随伴徴候の発現状況※1
随伴徴候の一部はinfusion reactionと鑑別が困難である。
| 海外第Ⅲ相 比較対照臨床試験6) |
海外第Ⅰ/Ⅱ相臨床試験8) | 国内第Ⅰb/Ⅱ相臨床試験9) | ||||||
|---|---|---|---|---|---|---|---|---|
| 本剤投与群 (n=267) |
5~15μg/m2/日 (n=70) |
18歳以上 (n=26) |
18歳未満 (n=9) |
|||||
| 全グレード | グレード3 以上 |
全グレード | グレード3 以上 |
全グレード | グレード3 以上 |
全グレード | グレード3 以上 |
|
| CRSの随伴徴候 | 42(15.7%) | 25(9.4%) | 10(14.3%) | 8(11.4%) | 11(42.3%) | 7(26.9%) | 5(55.6%) | 4(44.4%) |
| 発熱 | 15(5.6%) | 1(0.4%) | 7(10.0%) | 0 | 1(3.8%) | 0 | 3(33.3%) | 2(22.2%) |
| ALT増加 | 9(3.4%) | 6(2.2%) | 3(4.3%) | 3(4.3%) | 1(3.8%) | 0 | 2(22.2%) | 1(11.1%) |
| 発熱性好中球減少症 | 8(3.0%) | 8(3.0%) | 0 | 0 | 3(11.5%) | 3(11.5%) | 1(11.1%) | 1(11.1%) |
| 頭痛 | 8(3.0%) | 0 | 0 | 0 | 1(3.8%) | 0 | 1(11.1%) | 0 |
| 低リン酸血症 | 4(1.5%) | 3(1.1%) | 4(5.7%) | 1(1.4%) | 0 | 0 | 0 | 0 |
| 貧血 | 4(1.5%) | 4(1.5%) | 3(4.3%) | 2(2.9%) | 1(3.8%) | 1(3.8%) | 2(22.2%) | 2(22.2%) |
| 低血圧 | 4(1.5%) | 0 | 3(4.3%) | 1(1.4%) | 1(3.8%) | 0 | 1(11.1%) | 0 |
| 低カリウム血症 | 3(1.1%) | 1(0.4%) | 2(2.9%) | 1(1.4%) | 3(11.5%) | 1(3.8%) | 1(11.1%) | 0 |
| 血中ビリルビン増加 | 3(1.1%) | 1(0.4%) | 1(1.4%) | 1(1.4%) | 0 | 0 | 3(33.3%) | 1(11.1%) |
| 体重増加 | 1(0.4%) | 0 | 4(5.7%) | 2(2.9%) | 1(3.8%) | 0 | 0 | 0 |
| 高血圧 | 0 | 0 | 5(7.1%) | 3(4.3%) | 0 | 0 | 1(11.1%) | 0 |
| 嘔吐 | 0 | 0 | 3(4.3%) | 0 | 1(3.8%) | 0 | 0 | 0 |
| 低カルシウム血症 | 0 | 0 | 3(4.3%) | 2(2.9%) | 0 | 0 | 2(22.2%) | 1(11.1%) |
| 頻呼吸 | 0 | 0 | 3(4.3%) | 0 | 0 | 0 | 0 | 0 |
| 播種性血管内凝固 | 0 | 0 | 1(1.4%) | 0 | 5(19.2%) | 0 | 0 | 0 |
MedDRA/J ver.20.0(国内第Ⅰb/Ⅱ相臨床試験9)、海外第Ⅲ相比較対照臨床試験6))、MedDRA/J ver.19.0(海外第Ⅰ/Ⅱ相臨床試験8))
随伴徴候の定義:CRSに関連する事象の発現日を含む前後7日間に発現した有害事象(MedDRA/J PT)をCRSの随伴徴候とした。
※1:本剤投与時に3例以上に認められ、かつ発現率が3%以上であったCRSの随伴徴候
4)対処法
CRSが発現した場合は、中止、中断又は減量などの適切な処置を行ってください。(「副作用による投与量の調節について」参照)
臨床試験における処置内容を参考に適切に処置してください。(「重篤なCRS発現一覧」参照)
なお、臨床試験6,7)では、治験薬投与中の発熱全般への対処として、以下を推奨していました。
非ステロイド性抗炎症薬(NSAID)は可能な限り使用せず、第一選択薬としてアセトアミノフェン及び/又はデキサメタゾンを推奨する。感染による発熱の場合は、抗生物質の使用を検討し、デキサメタゾンの使用は避ける。
5)重篤なCRS発現一覧
| 試験名 | 症例 | 発現した事象 | グレード | 本剤との 因果関係 |
発現時期 (投与開始 後日数) |
本剤の 投与変更 |
実施した薬物治療 | 転帰 |
|---|---|---|---|---|---|---|---|---|
| 海外第Ⅲ相 比較対照臨床試験6) |
1 | 貪食細胞性 組織球症 |
3 | あり | 22日 | 投与中止 | デキサメタゾン トシリズマブ |
回復 |
| 2 | CRS | 3 | あり | 3日 | 中断 | デキサメタゾン メチルプレドニゾロン |
回復 | |
| 3 | 貪食細胞性 組織球症 |
3 | なし | 46日 | 投与中止 | メチルプレドニゾロン デキサメタゾン |
未回復 | |
| 4 | CRS | 3 | あり | 4日 | 中断 | デキサメタゾン | 回復 | |
| 5 | CRS | 3 | あり | 2日 | 中断 | デキサメタゾン | 回復 | |
| 6 | CRS | 2 | あり | 9日 | なし | なし | 回復 | |
| 7 | 貪食細胞性 組織球症 |
4 | あり | 8日 | 中断 | デキサメタゾン プレドニゾン※2 エトポシド |
回復 | |
| 8 | CRS | 3 | あり | 47日 | 中断 | メチルプレドニゾロン デキサメタゾン |
回復 | |
| 9 | CRS | 3 | あり | 7日 | 中断 | デキサメタゾン | 回復 | |
| 10 | CRS | 3 | あり | 1日 | 中断 | デキサメタゾン | 回復 | |
| 海外第Ⅰ/Ⅱ相 臨床試験8) |
11 | 貪食細胞性 組織球症 |
3 | あり | 41日 | なし | プレドニゾン※2 | 未回復 |
| 12 | CRS | 3 | あり | 3日 | 中断 | デキサメタゾン ヒドロコルチゾン |
回復 | |
| 13 | CRS | 3 | あり | 10日 | 投与中止 | デキサメタゾン | 回復 | |
| 14 | CRS | 3 | あり | 1日 | 中断 | デキサメタゾン | 回復 | |
| 15 | CRS | 4 | あり | 51日 | 投与中止 | デキサメタゾン | 回復 | |
| 国内第Ⅰb/Ⅱ相 臨床試験9) |
16 | CRS | 4 | あり | 6日 | 投与中止 | デキサメタゾン トシリズマブ メチルプレドニゾロン |
回復 |
MedDRA/J ver.20.0(国内第Ⅰb/Ⅱ相臨床試験9)、海外第Ⅲ相比較対照臨床試験6))、MedDRA/J ver.19.0(海外第Ⅰ/Ⅱ相臨床試験8))
※2:国内未承認
6)承認時評価資料(海外第Ⅲ相試験(00103311試験))
7)承認時評価資料(海外第Ⅱ相試験(20120216試験))
8)承認時評価資料(海外第Ⅰ/Ⅱ相試験(MT103-205試験))
9)承認時評価資料(国内第Ⅰb/Ⅱ相試験(20130265試験))
『ビーリンサイト.jp』はアムジェンが運営する医療関係者向け情報サイトです。
こちらのページでは、抗悪性腫瘍剤/二重特異性抗体製剤ビーリンサイト(ブリナツモマブ)の重要な副作用とその対策 サイトカイン放出症候群(CRS)をお届けいたします。













 でログイン
でログイン